1.化学反应原理![]()
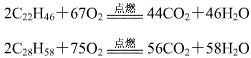
蜡烛由石蜡和绵芯组成,主要反应是石蜡与空气中的氧气发生的氧化反应。石蜡的主要成分是固态烷烃类物质的混合物,其中二十二碳烷和二十八碳烷含量最高。![]()
![]()
反应过程中,伴随有熔化、放热、发光等现象。 ![]()
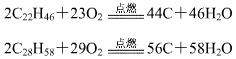
由于石蜡中固态烷烃中碳的质量分数高,在空气中较难充分燃烧,故反应过程中有少量的黑烟生成。![]()
![]()
烛焰也分三层,最内层几乎不能接触空气(氧气),没有发生燃烧,故焰心部分基本上由石蜡蒸气组成,颜色很浅,呈浅蓝色;中间部分接触空气(氧气),但接触不充分,产生不完全燃烧,有大量固体的炭粒产生,故温度不太高,但由于固体颗粒受热激发发生较明亮的可见光,因此,内焰部分最明亮,呈明亮的黄色火焰;外层接触空气(氧气)充分,燃烧完全,基本不产生固体颗粒,因此火焰颜色很淡(几乎不易观察到或显较浅的橙红色),但由于燃烧充分,产生的热量多,故温度最高。![]()
2.实验仪器:烧杯、玻璃片、火柴。![]()
实验药品:蜡烛、澄清石灰水。![]()
3.探究方案:![]()
⑴ 点燃前探究:观察蜡烛的外观(包括颜色、状态、形态、组成、结构、硬度、密度等)。![]()
蜡烛由石和棉芯组成;常做成圆柱状;石蜡本身是半透明状的白色,一般的蜡烛因添加了不同颜料而呈不同的颜色,最常见的是本色或红色;可做成不同的形状;硬度小,可用小刀切割;取一小块放入水中,石蜡浮在水层上,说明密度比水小。![]()
⑶ 燃着时探究:点燃蜡烛,观察石蜡的熔化、蜡烛被点燃及燃烧现象,观察火焰的分层情况等。![]()
用燃着的火柴慢慢靠近烛芯,观察蜡烛的熔化到被点燃的过程。![]()
蜡烛火焰的外焰的亮度太低,不易观察。因此,要引导学生认真观察。![]()